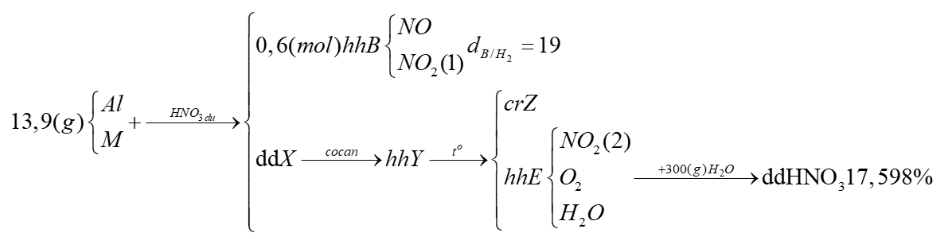Cho 19,5 gam hỗn hợp Al và kim loại M tác dụng với dung dịch HNO3 dư, thu được dung dịch X (không chứa muối amoni) và 0,6 mol hỗn hợp B (gồm NO và NO2) có tỉ khối so với H2 bằng 19. Cô cạn X thu được m gam hỗn hợp muối Y. Nung Y đến khối lượng không đổi thu được chất rắn Z và hỗn hợp E gồm khí và hơi. Cho toàn bộ E vào 300 gam nước, không có khí thoát ra và dung dịch thu được chỉ chứa một chất tan, có nồng độ 17,598%. Giá trị của m gần nhất với giá trị nào sau đây?
Hướng dẫn:
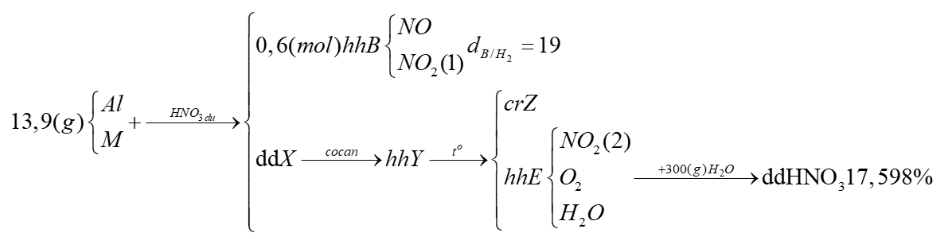
Nung Y là các muối nitrat đến khối lượng không đổi thu được chất rắn Z và hỗn hợp E gồm khí và hơi, chứng tỏ Y là muối ngậm nước.
Gọi số mol của NO và NO2 là a và b, ta có hệ phương trình:
 nNO = nNO2 = 0,3 mol
nNO = nNO2 = 0,3 mol
 nHNO3 p/ư = 4.0,3 + 2.0,3 = 1,8 (mol)
nHNO3 p/ư = 4.0,3 + 2.0,3 = 1,8 (mol)
mmuối nitrat = 19,5 + 62.(3.0,3 + 0,3) = 93,9 (gam)
Vì hỗn hợp E gồm khí và hơi. Cho toàn bộ E vào 300 gam nước, không có khí thoát ra chứng tỏ E gồm hơi nước, NO2 và O2 trong đó nNO2 : nO2 = 4 : 1.
Khi nhiệt phân Y:
Bảo toàn N: nNO2 (2) = 1,8 – 0,6 = 1,2 (mol)
Bảo toàn electron: nO2 =  = 0,3 (mol)
= 0,3 (mol)
Cho toàn bộ E vào nước → dung dịch chỉ chứa một chất tan là HNO3 (1,2 mol).
Theo đề thì Y là muối ngậm nước. Gọi x là lượng nước thu được do nhiệt phân Y, ta có:
CHNO3 =  = 0,17598
= 0,17598  x = 64,8
x = 64,8
 m = mY = 93,9 + 64,8 = 158,7 (gam)
m = mY = 93,9 + 64,8 = 158,7 (gam)