Ammonia là một hợp chất vô cơ có công thức phân tử NH3. Ở điều kiện tiêu chuẩn, nó là một chất khí, không màu, có mùi khai, tan nhiều trong nước do hình thành liên kết hydrogen với phân tử nước. Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại tối đa bao nhiêu loại liên kết hydrogen?
Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại 4 loại liên kết hydrogen:
| Kiểu 1 | 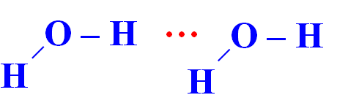 |
| Kiểu 2 | 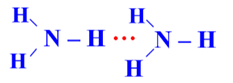 |
| Kiểu 3 | 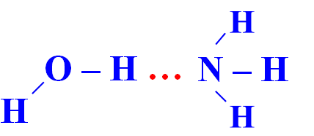 |
| Kiểu 4 | 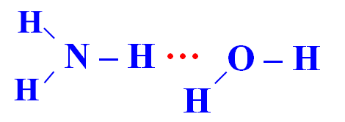 |








