Nếu nguyên tử X có 3 e hoá trị và nguyên tử Y có 6 e hoá trị, thì công thức của hợp chất ion đơn giản nhất tạo bởi X và Y là :
X sẽ có xu hướng nhường 3e tạo cation X3+, Y có xu hướng nhận 2e để tạo anion Y2-
Hợp chất tạo thành có dạng: X2Y3
Cùng nhau thử sức với bài kiểm tra 15 phút Hóa 10 Chương 3 Liên kết hóa học.
Nếu nguyên tử X có 3 e hoá trị và nguyên tử Y có 6 e hoá trị, thì công thức của hợp chất ion đơn giản nhất tạo bởi X và Y là :
X sẽ có xu hướng nhường 3e tạo cation X3+, Y có xu hướng nhận 2e để tạo anion Y2-
Hợp chất tạo thành có dạng: X2Y3
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
Viết cấu hình electron của các nguyên tử có số hiệu nguyên tử Z = 12, 9, 11, 10
Nguyên tử nào có 2 electron ở lớp ngoài cùng
→ Có xu hướng nhường 2 electron
Z = 12: 1s22s22p63s2
Z = 9: 1s22s22p5
Z = 11: 1s22s22p63s1
Z = 10: 1s22s22p6
Ta thấy nguyên tử có Z = 12 thì có 2 electron ở lớp ngoài cùng
→ Có xu hướng nhường 2 electron.
Phát biểu nào sau đây sai khi nói về các hợp chất ion?
Phát biểu "Các hợp chất ion không tan trong nước." ⇒ sai vì Các hợp chất ion tan nhiều trong nước.
Số liên kết π và liên kết σ trong phân tử C2H4 là
Công thức cấu tạo của C2H4: CH2=CH2
Trong phân tử có 1 liên kết π (trong liên kết C=C) và 5 liên kết σ (4 liên kết C-H và 1 liên kết trong C=C).
Để đạt được cấu hình bền vững, nguyên tử aluminium (Z = 13) có xu hướng nhường 3 electron. Sơ đồ nào dưới đây biểu diễn đúng quá trình trên?
Sơ đồ biểu diễn đúng quá trình là Al → Al3+ + 3e.
Công thức được viết dựa trên công thức electron, trong đó mỗi cặp electron chung được thay bằng một gạch nối “–” gọi là
Công thức được viết dựa trên công thức electron, trong đó mỗi cặp electron chung được thay bằng một gạch nối “–” gọi là công thức Lewis.
Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì
Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
Phát biểu nào sau đây không đúng?
Nhận định: “Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết” không đúng do vẫn có thể có AO s xen phủ với AO p.
Liên kết hydrogen là loại liên kết hóa học được hình thành giữa các nguyên tử nào sau đây?
Liên kết hydrogen là loại liên kết hóa học được hình thành giữa F, O, N,.. có độ âm điện lớn đồng thời có cặp electron hóa trị chưa kiên kết và nguyên tử hydrogen linh động.
Cho cấu hình electron nguyên tử các nguyên tố sau:
a) 1s2
b) 1s22s22p6
c) 1s22s22p63s23p6
d) 1s22s22p63s2
e) 1s22s22p63s23p4
Cấu hình electron nguyên tử các nguyên tố sau:
a) 1s2 He (Z=2)
b) 1s 2s 2p Ne (Z=10)
c) 1s22s22p63s23p6: Ar (Z =18)
d) 1s22s22p63s2: Mg (Z = 12)
e) 1s22s22p63s23p4: S (Z = 16)
Cấu hình của các nguyên tố khí hiếm là: He, Ne, Ar.
Cho bảng sau một số thông tin về các nguyên tố sodium và sulfur:
|
Nguyên tố |
Sodium (Na) |
Sulfur |
|
Số hiệu nguyên tử |
11 |
16 |
Sodium sulfide là một hợp chất ion. Phản ứng tạo thành sodium sulfide nào sau đây đúng
Giai đoạn 1: Na → Na+ + 1e
Cấu hình [Ne]3s1 [Ne]
S + 2e → S2-
Cấu hình electron: [Ne]3s23p4 [Ar]
Giai đoạn 2: Cation Na+ và anion S2- hút nhau bằng lực hút tĩnh điện tạo liên kết ion
2Na+ + S2- → Na2S
Phản ứng tạo thành sodium sulfide là 2Na + S Na2S
Khẳng định nào sau đây sai?
Trong tinh thể phân tử, các phân tử liên kết với nhau bằng lực tương tác yếu giữa các phân tử.
Độ âm điện của các phi kim giảm dần theo thứ tự F, Cl, Br, H. Lực kéo electron về phía nguyên tử nitrogen mạnh nhất ở liên kết nào dưới đây?
Do nguyên tử H có độ âm điện nhỏ nhất nên lực kéo electron về phía nguyên tử nitrogen mạnh nhất ở liên kết N – H.
X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
X thuộc nhóm IA là kim loại điển hình, điện tích 1+.
Y thuộc nhóm VIIA là phi kim điển hình, điện tích 1-.
Công thức hợp chất là XY, liên kết giữa X và Y là liên kết ion.
Ở cùng điều kiện, giữa các phân tử đơn chất halogen nào sau đây có tương tác van der Waals mạnh nhất?
Các phân tử càng lớn và càng nhiều electron thì sự hỗn loạn của lớp vỏ electron càng lớn, tương tác khuếch tán giữa các phân tử càng mạnh ⇒ Tương tác van der Waals càng lớn.
Từ F2 đến I2 các phân tử có độ lớn tăng dần (vì bán kính nguyên tử tăng dần từ F đến I) và số electron tăng dần ⇒ Tương tác van der Waals tăng dần.
Vậy tương tác van der Waals mạnh nhất ở I2.
Cho công thức Lewis của phân tử NH3 dưới đây. Số electron dùng chung, số electron hóa trị riêng của N lần lượt là
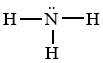
Từ công thức lewis của NH3 ta thấy số electron dùng chung là 6, số electron hóa trị riêng của N là 2.
Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn
Giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn bằng một nối đơn (–) và gọi là liên kết đơn.
Giữa hai nguyên tử có hai cặp electron chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
Giữa hai nguyên tử có ba cặp electron chung thì ba cặp electron này được biểu diễn bằng một nối ba (≡) và gọi là liên kết ba.
Trong dãy HX, các acid HCl, HBr, HI là acid mạnh nhưng HF là acid yếu Vì:
Do trong các phân tử HF có liên kết hydrogen làm giảm tính acid của HF nên HF là acid yếu. Sơ đồ liên kết hydrogen giữa các phân tử hydrogen fluoride: ...F-H...F-H…
Khi hình thành liên kết hóa học trong phân tử NaF:
Ta có:
Na (Z = 11): 1s22s22p63s1 ⇒ Có 1 electron lớp ngoài cùng nên có xu hướng nhường 1 electron.
F (Z = 9): 1s22s22p5 ⇒ Có 7 electron lớp ngoài cùng nên có xu hướng nhận 1 electron.
Khi hình thành liên kết hóa học trong phân tử NaF: nguyên tử Na nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm.
Các hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau.
Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh
Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng.
Khi đó, nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
