Nhiệt tạo thành chuẩn của khí oxygen trong phản ứng hóa học là?
Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0.
Cùng nhau thử sức với bài kiểm tra 15 phút Hóa 10 Chương 5. Năng lượng hóa học.
Nhiệt tạo thành chuẩn của khí oxygen trong phản ứng hóa học là?
Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0.
Cho phản ứng sau đây là phản ứng thu nhiệt:
CH4 (g) + H2O (l) → CO (g) + 3H2 (g)
Giá trị ![]() nào sau đây là đúng?
nào sau đây là đúng?
Vì phản ứng thu nhiệt nên > 0 ⇒
= 250 kJ.
Kí hiệu của biến thiên enthalpy chuẩn là
Kí hiệu của biến thiên enthalpy chuẩn là
Dựa vào phương trình nhiệt hoá học của phản ứng sau?
N2 (g) + 3H2 (g) ⟶ 2NH3 (g) ![]()
Giá trị ![]() của phản ứng: 2NH3 (g) ⟶ 2N2 (g) + 3H2 (g)
của phản ứng: 2NH3 (g) ⟶ 2N2 (g) + 3H2 (g)
Do N2 (g) + 3H2 (g) ⟶ 2NH3 (g)
Nên 2NH3 (g) ⟶ 2N2 (g) + 3H2 (g)
Cho phương trình nhiệt hóa học: 2H2(g) + O2(g) → 2H2O(l) ![]() = –571,68 kJ. Phản ứng trên là phản ứng
= –571,68 kJ. Phản ứng trên là phản ứng
Phản ứng có = –571,68 kJ ⇒ Phản ứng tỏa nhiệt.
Phản ứng (1) xảy ra làm nóng môi trường xung quanh, phản ứng (2) xảy ra làm lạnh môi trường xung quanh. Phát biểu nào sau đây đúng?
Một số phản ứng khi xảy ra sẽ làm nóng môi trường xung quanh tức là phản ứng xảy ra kèm theo giải phóng năng lượng dưới dạng nhiệt ⇒ Phản ứng tỏa nhiệt.
Một số phản ứng khi xảy ra sẽ làm lạnh môi trường xung quanh tức là phản ứng hấp thu năng lượng dưới dạng nhiệt từ môi trường xung quanh. ⇒ Phản ứng thu nhiệt
Phản ứng (1) tỏa nhiệt; phản ứng (2) thu nhiệt.
Cho năng lượng liên kết của một số liên kết như sau:
| Liên kết | H-H | C-H | C-C | C≡C |
| Eb(kJ/mol) | 432 | 413 | 347 | 839 |
Tính biến thiên enthalpy chuẩn của các phản ứng:
H3C-C≡CH (g) + 2H2(g) → CH3-CH2-CH3 (g)
Phản ứng:
H3C-C≡CH(g) + 2H2(g) → CH3-CH2-CH3 (g)
Cho phản ứng nhiệt nhôm sau:
2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)
Biết nhiệt tạo thành, nhiệt dung của các chất (nhiệt lượng cần cung cấp để 1 kg chất đó tăng lên 1 độ) được cho trong bảng sau:
|
Chất |
|
C (J/g.K) |
Chất |
|
C (J/g.K) |
|
Al |
0 |
Al2O3 |
-1669,74 |
0,84 |
|
|
Fe2O3 |
–822,4 |
Fe |
0 |
0,67 |
Giả thiết phản ứng xảy ra vừa đủ, hiệu suất 100%; nhiệt độ ban đầu là 25oC; nhiệt lượng tỏa ra bị thất thoát ngoài môi trường là 50%. Tính nhiệt độ đạt được trong lò phản ứng nhiệt nhôm.
Xét phản ứng giữa 2 mol Al với 1 mol Fe2O3 tạo 1 mol Al2O3 và 2 mol Fe
ΔrHo298 = -1669,74 + 2.0 – 2.0 – ( –822,4) = -847,34 kJ
Nhiệt dung của phẩm: C = 102.0,84 + 56.2.0,67 = 160,72 (J/K)
Nhiệt độ đạt được là: (25+ 273) + 2636 = 2934K
Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới đây. Kết luận nào sau đây là đúng?
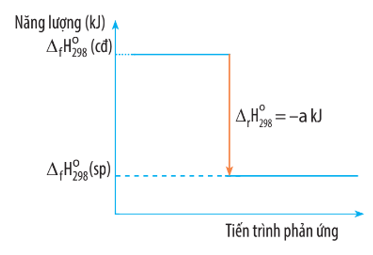
Từ sơ đồ ta thấy: (sp) <
(cđ) nên
< 0 và
= -a kJ
Do đó đây là phản ứng tỏa nhiệt.
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) → 2NO(g) ![]() = +180 kJ
= +180 kJ
Kết luận nào sau đây đúng?
Theo bài ra ta có: = +180 kJ > 0
Phản ứng hấp thụ nhiệt năng từ môi trường
Phản ứng tạo thành propene từ propyne:
CH3−C≡CH(g) + H2(g) ![]() CH3−CH=CH2(g)
CH3−CH=CH2(g)
a) Hãy xác định số liên kết C–H; C–C; C≡C trong hợp chất CH3–C≡CH (propyne).
b) Cho năng lượng của các liên kết:
| Liên kết | C – H | C – C | C = C | C ≡ C | H - H |
| Eb (KJ/mol) | 414 | 347 | 614 | 839 | 432 |
Hãy tính biến thiên enthalpy của phản ứng tạo thành propene trên.
Phản ứng tạo thành propene từ propyne:
CH3−C≡CH(g) + H2(g) CH3−CH=CH2(g)
a) Hãy xác định số liên kết C–H; C–C; C≡C trong hợp chất CH3–C≡CH (propyne).
b) Cho năng lượng của các liên kết:
| Liên kết | C – H | C – C | C = C | C ≡ C | H - H |
| Eb (KJ/mol) | 414 | 347 | 614 | 839 | 432 |
Hãy tính biến thiên enthalpy của phản ứng tạo thành propene trên.
a) Trong hợp chất CH3–C≡CH có 4 liên kết C–H; 1 liên kết C–C và 1 liên kết C≡C.
b) = [Eb(C≡C) + 4Eb(C–H) + Eb(C–C) + Eb(H–H)] – [ 6Eb(C–H) + Eb(C=C) + Eb(C–C)]
⇒ = –171 kJ
Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) được xác định trong điều kiện nhiệt độ thường được chọn là
Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) được xác định trong điều kiện nhiệt độ thường được chọn là 25oC (298K).
Cho phản ứng sau:
2NaCl(s) → 2Na(s) + Cl2(g)
Biết ![]() của NaCl là –411,2 kJ/mol. Trong quá trình nấu ăn, dù bị đun nóng nhưng muối ăn không bị phân hủy thành khí Cl2 độc, vì
của NaCl là –411,2 kJ/mol. Trong quá trình nấu ăn, dù bị đun nóng nhưng muối ăn không bị phân hủy thành khí Cl2 độc, vì
= –2.
(NaCl(s)) = –2. (–411,2) = 822,4 kJ
rất dương nên phản ứng không thuận lợi xảy ra.
Biến thiên enthalpy chuẩn của một phản ứng hoá học (ở điều kiện chuẩn) được kí hiệu là
Biến thiên enthalpy chuẩn của một phản ứng hoá học (ở điều kiện chuẩn) được kí hiệu là
.
Nhiệt tạo thành chuẩn (![]() ) của các đơn chất ở dạng bền vững nhất là
) của các đơn chất ở dạng bền vững nhất là
Enthalpy tạo thành chuẩn của các đơn chất bền đều bằng không.
Dựa vào phương trình nhiệt hoá học của các phản ứng sau:
CS2(l) + 3O2(g) ![]() CO2(g) + 2SO2(g)
CO2(g) + 2SO2(g) ![]() = - 1110,21 kJ (1)
= - 1110,21 kJ (1)
CO2(g) → CO(g) + O2(g) ![]() = +280,00 kJ (2)
= +280,00 kJ (2)
Na(s) + 2H2O(l) → NaOH(aq) + H2(g) ![]() = - 367,50 kJ (3)
= - 367,50 kJ (3)
ZnSO4(s) → ZnO(s) + SO2(g) ![]() = + 235,21 kJ (4)
= + 235,21 kJ (4)
Cặp phản ứng tỏa nhiệt là:
Phản ứng tỏa nhiệt có < 0.
Phản ứng thu nhiệt có > 0.
Cặp phản ứng tỏa nhiệt là (1) và (3).
Phát biểu nào dưới đây là sai?
C sai, vì không phải tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
Ví dụ: CaCO3 → CaO + CO2 là phản ứng thu nhiệt.
Cho các chất sau, chất nào có nhiệt tạo thành chuẩn bằng 0?
Chất có nhiệt tạo thành chuẩn bằng 0 là O2 (g)
Cho phương trình nhiệt hóa học sau: H2(g) + I2(g) → 2HI(g) = +11,3 kJ.
a) Phản ứng giải phóng nhiệt lượng 11,3 kJ khi 2 mol HI được tạo thành. Sai||Đúng
b) Tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm. Đúng||Sai
c) Năng lượng chứa trong H2 và I2 cao hơn trong HI. Sai||Đúng
d) Phản ứng xảy ra với tốc độ chậm. Sai||Đúng
Cho phương trình nhiệt hóa học sau: H2(g) + I2(g) → 2HI(g) = +11,3 kJ.
a) Phản ứng giải phóng nhiệt lượng 11,3 kJ khi 2 mol HI được tạo thành. Sai||Đúng
b) Tổng nhiệt phá vỡ liên kết của chất phản ứng lớn hơn nhiệt tỏa ra khi tạo thành sản phẩm. Đúng||Sai
c) Năng lượng chứa trong H2 và I2 cao hơn trong HI. Sai||Đúng
d) Phản ứng xảy ra với tốc độ chậm. Sai||Đúng
a) Sai:
Vì = +11,3 kJ > 0 ⇒ phản ứng thu nhiệt.
b) Đúng
phản ứng thu nhiệt nên tổng nhiệt cần cung cấp để phá vỡ liên kết lớn hơn nhiệt giải phóng khi tạo sản phẩm.
c) Sai: phân tử H2 và I2 có liên kết bền hơn HI, nghĩa là mức năng lượng thấp hơn.
d) Sai
vì Phát biểu không nói về sự trao đổi năng lượng của phản ứng.
Phản ứng nào sau đây là phản ứng tỏa nhiệt?
Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt:
∆rH0298 > 0: phản ứng thu nhiệt.
∆rH0298 < 0: phản ứng tỏa nhiệt.
Xét phản ứng
C4H10 (g) + 13O2 8CO2 (g) + 10H2O (l)
∆rH0298 = -5316,0 kJ < 0 phản ứng tỏa nhiệt.
