P (s, đỏ) → P (s, trắng) ΔrHo298 = +17,6 kJ
Nhận xét nào sau đây là đúng?
P (s, đỏ) → P (s, trắng) = +17,6 kJ
Ta có:
= +17,6 kJ > phản ứng là phản ứng thu nhiệt.
P đỏ bền hơn P trắng.
Cùng nhau thử sức, ôn luyện đề kiểm tra học kì 2 Hóa 10 cùng với Khoahoc nha!
P (s, đỏ) → P (s, trắng) ΔrHo298 = +17,6 kJ
Nhận xét nào sau đây là đúng?
P (s, đỏ) → P (s, trắng) = +17,6 kJ
Ta có:
= +17,6 kJ > phản ứng là phản ứng thu nhiệt.
P đỏ bền hơn P trắng.
Theo chiều từ F → Cl → Br → I, giá trị độ âm điện của các nguyên tố
Theo chiều từ F → Cl → Br → I, giá trị độ âm điện của các nguyên tố giảm dần
Cho phản ứng đơn giản xảy ra trong bình kín: 2CO(g) + O2(g) ⟶ 2CO2(g).
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ CO gấp 2 lần, nồng độ O2 không đổi.
Theo định luật tác dụng khối lượng, tốc độ tức thời của phản ứng là:
Nếu tăng nồng độ CO gấp 2 lần, ta có:
= k.(2.CCO)2.CO2 =
=
Vậy tốc độ phản ứng tăng gấp 4 lần.
Phát biểu nào sau đây là không đúng?
Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng tỏa nhiệt.
Cho phản ứng: 2KClO3(s) ![]() 2KCl(s) + 3O2(g). Yếu tố không ảnh hưởng đến tốc độ của phản ứng trên là:
2KCl(s) + 3O2(g). Yếu tố không ảnh hưởng đến tốc độ của phản ứng trên là:
Áp suất không ảnh hưởng đến phản ứng trên do phản ứng không có chất khí tham gia.
Cho mẩu giấy màu ẩm vào bình khí chlorine. Hiện tượng xảy ra là
Giấy màu ẩm làm cho khí chlorine tiếp xúc với giấy màu ẩm theo.
Mà khí chlorine ẩm có tính tẩy màu.
Cl2 + H2O ⇄ HCl + HClO (HClO có tính tẩy màu)
Do đó tờ giấy màu bị mất màu.
Yếu tố nào liên quan đến sự ảnh hưởng của xúc tác với tốc độ phản ứng?
Ảnh hưởng của chất xúc tác đến tốc độ phản ứng được giải thích dựa vào năng lượng hoạt hóa. Đây là năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hóa học.
Khi có xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hóa thấp hơn so với phản ứng không xúc tác. Do đó số hạt có đủ năng lượng hoạt hóa sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ![]() mol H2 (thể khí) phản ứng với
mol H2 (thể khí) phản ứng với ![]() mol I2 (thể rắn) để thu được 1 mol HI (thể khí). Ta nói enthakpy tạo thành của HI khí ở điều kiện chuẩn là 26,48 kJ mol-1. Phản ứng trên được biểu diễn như sau:
mol I2 (thể rắn) để thu được 1 mol HI (thể khí). Ta nói enthakpy tạo thành của HI khí ở điều kiện chuẩn là 26,48 kJ mol-1. Phản ứng trên được biểu diễn như sau:
![]()
Ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là bao nhiêu kJ?
→ Ở điều kiện chuẩn, khi cho mol H2, phản ứng với
I2, thu được sản phẩm là 1 mol HI thì sẽ giải phóng một nhiệt lượng là 26,48 kJ
Ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là bao nhiêu kJ là: 26,48 . 3 = 79,44 kJ.
Chỉ dùng duy nhất một loại thuốc thử là AgNO3 có thể nhận ra tối đa bao nhiêu chất trong các dung dịch sau: NaF, NaCl, NaBr, NaI?
Trích mẫu thử từng dung dịch và đánh số thứ tự, nhỏ AgNO3 lần lượt vào các mẫu thử:
AgNO3 + NaCl → AgCl↓ + NaNO3
AgNO3 + NaBr → AgBr↓ + NaNO3
AgNO3 + NaI → AgI↓ + NaNO3
Vậy có thể nhận biết cả 4 dung dịch.
Điều nào đúng khi nói về vai trò của các chất tham gia sơ đồ phản ứng oxi hóa khử sau?
KMnO4 + HCl ![]() KCl + MnCl2 + Cl2 + H2O
KCl + MnCl2 + Cl2 + H2O
Chất khử (chất bị oxi hóa) là chất nhường electron
Chất oxi hóa (chất bị khử) là chất nhận electron
Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron
Quá trình khử (sự khử) là quá trình thu electron
Xác định sự thay đổi số oxi hóa của các nguyên tố
HCl là chất khử
KMnO4 là chất oxi hóa
|
x5 x2 |
|
⇒ 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O.
Halogen ở thể rắn (điều kiện thường), có tính thăng hoa là
Nồi áp suất dùng để ninh, hầm thức ăn có thể làm nóng nước tới nhiệt độ 120oC so với 100oC khi dùng nồi thường. Trong quá trình hầm xương thường diễn ra nhiều phản ứng hóa học, ví dụ quá trình biến đổi các protein, chẳng hạn như thủy phân một phần collagen thành gelatin. Hãy cho biết tốc độ quá trình thủy phân collagen thành gelatin thay đổi như thế nào khi sử dụng nồi áp suất thay cho nồi thường.
Áp dụng mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ ta có:
Trong đó giá trị γ = 2 – 4
Với γ = 2 ⇒
Vậy tốc độ quá trình thủy phân collagen thành gelatin sẽ tăng lên ít nhất 4 lần khi sử dụng nồi áp suất thay cho nồi thường.
Cho m gam một đơn chất halogen (X2) tác dụng hết với magnesium thì thu được 9,5 gam muối. Mặt khác cho m gam X2 tác dụng hết với aluminium thì thu được 8,9 gam muối. Đơn chất halogen X2 là
Phương trình hóa học:
Mg + X2 → MgX2
2Al + 3X2 → 2AlX3
Bảo toàn nguyên tố X:
2nMgX2 = 3nAlX3
X = 35,5 (Cl)
Số oxi hóa của N trong ion NO3- là
Trong ion NO3-: x + 3.(-2) = -1 ⇒ x = 5
⇒ N có số oxi hóa là +5 trong hợp chất NO3-
Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
a) H2S + SO2 → S + H2O
b) Mg + HNO3 → Mg(NO3)2 + N2 + H2O
Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
a) H2S + SO2 → S + H2O
b) Mg + HNO3 → Mg(NO3)2 + N2 + H2O
a) Sự thay đổi số oxi hóa của các nguyên tử nguyên tố:
Quá trình oxi hóa - khử:
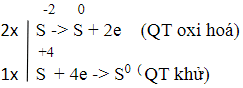
Cân bằng đúng là: 2H2S + SO2 → 3S+ 2H2O
b) Sự thay đổi số oxi hóa của các nguyên tử nguyên tố:
Quá trình oxi hóa - khử:
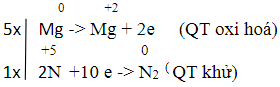
Cân bằng đúng là: 5Mg + 12HNO3 → 5Mg(NO3)2 + N2 + 6H2O
Nước biển có chứa một lượng nhỏ muối sodium bromide và potassium bromide. Trong việc sản xuất bromine từ các bromide có trong tự nhiên, để thu được 1 tấn bromine phải dùng hết 0,6 tấn chlorine. Hiệu suất phản ứng điều chế bromine từ chlorine là
Gọi công thức muối bromide là: MBr (M: là Na và K)
2MBr + Cl2 → 2MCl + Br2
Theo lí thuyết: 71 tấn 160 tấn
x tấn 1 tấn
Mà lượng Cl2 thực tế đã dùng là 0,6 tấn. Vậy hiệu suất phản ứng là:
Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 11. Nguyên tố X là
X có tổng số electron ở phân lớp p là 11 cấu hình e của X là: 1s22s22p63s23p5
X là Cl.
Số oxi hoá của nitrogen trong đơn chất là
Số oxi hóa của nguyên tử nguyên tố trong đơn chất bằng 0.
Phương trình nhiệt hoá học nào sau đây ứng với sơ đồ biểu diễn biến thiên enthalpy của phản ứng sau:
Quan sát sơ đồ ta có phương trình nhiệt hoá học ứng với sơ đồ biểu diễn biến thiên enthalpy của phản ứng là:
2ClF3(g) + 2O2(g) → Cl2O(g) + 3F2O(g), = +394,1 kJ.
Dung dịch chất nào sau đây được dùng để trung hòa môi trường base, hoặc thủy phân các chất trong quá trình sản xuất, tẩy rửa gỉ sắt (thành phần chính là các iron oxide) bám trên bề mặt của các loại thép?
Dung dịch nước của hydrogen chlorine là hydrochloric acid (HCl) được dùng để trung hòa môi trường base, hoặc thủy phân các chất trong quá trình sản xuất, tẩy rửa gỉ sắt (thành phần chính là các iron oxide) bám trên bề mặt của các loại thép.
Ví dụ: Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Hydrogen halide nào sau đây được dùng để tẩy cặn trong các thiết bị trao đổi nhiệt; chất xúc tác trong các nhà máy lọc dầu, công nghệ làm giàu uranium, sản xuất dược phẩm, …
Hydrogen fluoride được dùng để tẩy cặn trong các thiết bị trao đổi nhiệt; chất xúc tác trong các nhà máy lọc dầu, công nghệ làm giàu uranium, sản xuất dược phẩm…
Trong phản ứng Fe + CuSO4 → FeSO4 + Cu thì một mol Fe đã
Trong phản ứng xảy ra quá trình:
mol: 1 → 2
⇒ Một mol Fe đã nhường 2 mol electron.
Muốn khắc thủy tinh, người ta nhúng thủy tinh vào sáp nóng chảy và nhấc ra cho nguội, dùng vật nhọn tạo hình chữ, biểu tượng,… cần khắc. Sau đó, người ta sẽ chờ lớp sáp (nến) khô rồi nhỏ dung dịch HF vào thủy tinh và thu được sản phẩm được khắc theo mong muốn. Phương trình hóa học của phản ứng xảy ra khi khắc thủy tinh bằng dung dịch HF là
Phương trình hóa học:
4HF + SiO2 ⟶ SiF4 + 2H2O.
Cho V lít Cl2 (đktc) tác dụng với dung dịch NaOH loãng nguội, dư thu được m1 gam tổng khối lượng 2 muối. Cho V lít Cl2 (đktc) tác dụng với NaOH đặc, nóng thu được m2 gam tổng khối lượng 2 muối. Tỉ lệ m1 : m2 bằng
Giả sử ở mỗi phản ứng có 1 mol Cl2 phản ứng.
Ở nhiệt độ thường:
Cl2 + NaOH → NaCl + NaClO + H2O
1 → 1 → 1 mol
Ở nhiệt độ cao:
m1 = 58,5 + 74,5 = 133 gam (1)
3Cl2 + 6NaOH 5NaCl + NaClO3 + 3H2O
1 → →
mol
Từ (1) và (2) ta được m1 : m2 = 1 : 1
Ứng dụng nào sau đây không phải của Cl2?
Cl2 không được dùng để sát trùng vết thương trong y tế.
Cho phản ứng:
2Fe(s) + 1,5O2(g) ![]() Fe2O3(s)
Fe2O3(s) ![]()
Ý nghĩa của giá trị ![]() là
là
Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định. Kí hiệu là fH.
nghĩa là để tạo thành 1 mol chất Fe2O3(s) từ 2 mol Fe và 1,5 mol O2(g) giải phóng nhiệt lượng là 825,50 kJ.
Có một hỗn hợp gồm NaCl và NaBr. Cho hỗn hợp đó tác dụng với AgNO3 dư thì tạo ra kết tủa 25,975 gam kết tủa. Mặt khác, cho hỗn hợp đó tác dụng vừa đủ với 1,12 lít khí Cl2 (ở đktc). Phần trăm về số mol của NaBr trong hỗn hợp đầu là
Cho hỗn hợp NaCl và NaBr tác dụng vừa đủ với 1,12 lít khí Cl2 (ở đktc):
2NaBr + Cl2 → 2NaCl + Br2
0,1 0,05
Cho hỗn hợp đó tác dụng với AgNO3 dư thì tạo ra kết tủa 25,975 gam kết tủa:
AgNO3 + NaBr → AgBr↓ + NaNO3
0,1 → 0,1
AgNO3 + NaCl → AgCl↓ + NaNO3
0,1.188 + 143,5.nAgCl = 25,975
⇒ nAgCl = 0,05 mol
Phần trăm về số mol của NaBr trong hỗn hợp đầu là
Hòa tan một lượng copper (II) oxide vào dung dịch hydrochloric acid. Hiện tượng quan sát được là
Phương trình phản ứng:
CuO + 2HCl → CuCl2 + H2O
Hiện tượng quan sát được: Copper (II) oxide tan dần tạo dung dịch có màu xanh (CuCl2).
Kết luận nào sau đây sai?
Chỉ phản ứng hóa học có sự tham gia của chất khí, thì áp suất mới có thể ảnh hưởng đến tốc độ phản ứng.
Cho 2,13 gam hỗn hợp X gồm ba kim loại ở dạng bột tác dụng hoàn toàn với oxygen dư thu được hỗn hợp Y gồm các oxide có khối lượng 3,33 gam. Thể tích dung dịch HCl 2M vừa đủ để phản ứng hết với Y là:
Sơ đồ phản ứng:
Theo bảo toàn khối lượng ta có:
mO2 = moxide – mkim loại = 3,33 – 2,13 = 1,2 gam
⇒ nO2 = 0,0375 mol
⇒ nO = 2.nO2 = 0,075 mol
Từ sơ đồ ta thấy: nO (oxide) = nO (H2O)
⇒ nH2O = 0,075 (mol)
⇒ nHCl = 2nH2O = 0,15 mol
⇒ Vdd = 0,15:2 = 0,075 (lít) = 75 (ml)
