Chọn câu đúng trong các câu sau đây?
Phát biểu đúng là: Phenol tác dụng với dung dịch sodium hydroxide tạo thành muối và nước.
C6H5OH + NaOH → C6H5ONa + H2O
Cùng nhau thử sức với bài đánh giá năng lực cuối kì 2 Hóa học 11 nha!
Chọn câu đúng trong các câu sau đây?
Phát biểu đúng là: Phenol tác dụng với dung dịch sodium hydroxide tạo thành muối và nước.
C6H5OH + NaOH → C6H5ONa + H2O
Phản ứng của phenol với dung dịch potassium hydroxide (KOH) là phản ứng gì?
Phản ứng của phenol với dung dịch potassium hydroxide (KOH) là phản ứng trung hòa.
Phương trình phản ứng
C6H5OH + KOH → C6H5OK + H2O.
Formic acid (HCOOH) có trong nọc kiến, nọc ong, sâu róm. Nếu không may bị ong đốt thì nên bôi vào vết ong đốt loại chất nào sau đây là tốt nhất?
Vôi có thể trung hòa formic acid (HCOOH) có trong nọc ong nên nếu không may bị ong đốt thì nên bôi vôi vào vết ong đốt.
Chiều giảm dần độ linh động của nguyên tử H (trái sang phải) trong nhóm OH của 3 hợp chất: phenol (1), ethanol (2), 2-nitrophenol (3).
Ethanol không có sự tác động của nhân benzene Độ linh động của nguyên tử H trong nhóm OH là kém nhất.

Nhân benzene chứa nhóm NO2 hút electron mạnh hơn dẫn tới liên kết H-O phân cực mạnh hơn Độ linh động của nguyên tử H trong nhóm OH của 2-nitrophenol > phenol.
Chất nào dưới đây được sử dụng để tẩy rửa sơn mỏng tay, tẩy keo siêu dính, tẩy trên các đồ gốm sứ, thuỷ tinh; ngoài ra, còn được sử dụng làm phụ gia bảo quản thực phẩm.
Acetone (CH3COCH3) được sử dụng để tẩy rửa sơn mỏng tay, tẩy keo siêu dính, tẩy trên các đồ gốm sứ, thuỷ tinh; ngoài ra, còn được sử dụng làm phụ gia bảo quản thực phẩm.
Cho các hợp chất sau :
(a) HOCH2CH2OH (b) HOCH2CH2CH2OH (c) HOCH2CH(OH)CH2OH
(d) CH3CH(OH)CH2OH (e) CH3CH2OH (f) CH3OCH2CH3.
Các chất đều tác dụng được với Na, Cu(OH)2 là
Các chất cho trong bài đều là alcohol và ketone, điều kiện để chúng tác dụng được với cả Na và Cu(OH)2 là có ít nhất 2 nhóm OH gắn vào 2 carbon liền kề nhau.
Như vậy chỉ có các alcohol (a), (c), (d) thỏa mãn điều kiện này.
Có bốn chất lỏng có thể tích bằng nhau là ethanol, acetone, acetaldehyde, acetic acid. Tiến hành chưng cất hỗn hợp này, sau một thời gian, hàm lượng chất nào trong bình chưng cất còn lại lớn nhất?
Phương pháp chưng cất dựa trên nhiệt độ sôi khác nhau của các chất. Do acetic acid có nhiệt độ sôi cao nhất nên khi tiến hành chưng cất hỗn hợp, hàm lượng acetic acid còn lại trong bình chưng cất sẽ lớn nhất.
Acid được dùng để sản xuất thuốc cảm aspirin là
Salicylic acid được dùng sản xuất thuốc cảm aspirin, thuốc giảm đau methyl salicylate.
Tên gọi của alcohol có công thức cấu tạo
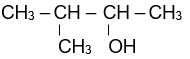
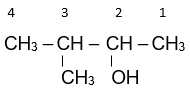
3-methylbutan-2-ol.
Đun nóng acetic acid với alcohol ethyl có sulfuric acid đặc làm xúc tác thì người ta thu được một chất lỏng không màu, mùi thơm, không tan trong nước và nổi trên mặt nước. Sản phẩm đó là
Phương trình hóa học
CH3COOH + C2H5-OH CH3COOC2H5 + H2O
⇒ sản phẩm thu được là: ethyl acetate
Aldehyde tác dụng với Cu(OH)2 trong môi trường kiềm (toC) thu được kết tủa màu đỏ gạch là
Trong môi trường kiềm, Cu(OH)2 oxi hóa hầu hết các aldehyde thành muối carboxylate và sinh ra kết tủa Cu2O có màu đỏ gạch.
A là hợp chất hữu cơ CxHyOz được 0,1 mol A cho toàn bộ sản phẩm vào nước vôi thu được 30 gam kết tủa. Đun nóng dụng dịch thu được tiếp 20 gam kết tủa. A vừa tác dụng với Na và NaOH. Biết 1 mol A tác dụng hết với Na thu được 0,5 mol khí H2 và A tác dụng với dung dịch bromine theo tỉ lệ 1:3 .Tên gọi cả A là
n↓ = 0,3 mol
Gọi công thức của A là CxHyOz
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,3 ← 0,3
2CO2 + Ca(OH)2 → Ca(HCO3)2
a → a/2
Ca(HCO3)2 CaCO3 + CO2 + H2O
0,2 ← 0,2
Theo bài ra ta có: a/2 = 0,2 ⇒ a = 0,4 (mol)
⇒ nCO2 = 0,3 + 0,4 = 0,7 (mol)
⇒ 0,1x = 0,7 mol
⇒ x = 7
Theo giả thiết:
Vậy công thức phân tử của A là C7H8O
Mặt khác: A phản ứng với Br2 theo tỉ lệ mol 1:3 nên A có công thức cấu tạo:
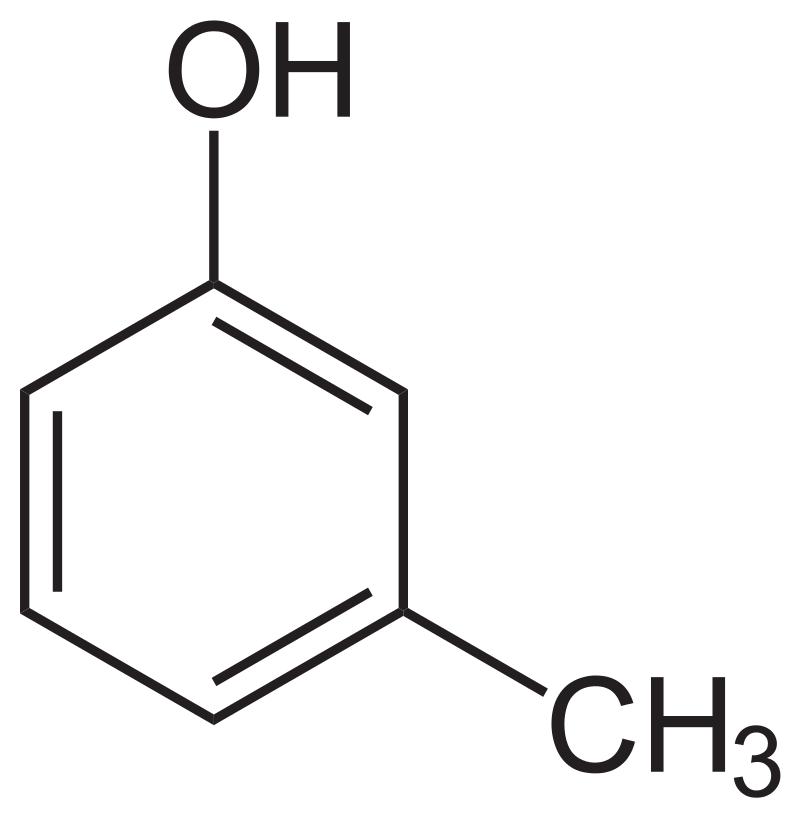
(m-cresol)
Cho dãy các chất sau: CH3COOH, CH3CHO, HCOOH, C2H5OH, CH3-C≡CH, CH2=CH-CH3. Số chất trong dãy có thể tham gia phản ứng dung dịch AgNO3/NH3 là:
Chất có thể tham gia phản ứng tráng bạc là: CH3CHO, HCOOH, CH3-C≡CH
Đồng phân dẫn xuất halogen gồm:
Dẫn xuất halogen có đồng phân mạch carbon giống như hydrocarbon. Ngoài ra, dẫn xuất halogen còn có đồng phân vị trí nhóm chức (vị trí các nguyên tử halogen).
Hydrate hóa 2 alkene chỉ tạo thành 2 alcohol. Hai alkene đó là:
Những alkene đối xứng khi thực hiện phản ứng Hydrate hóa chỉ cho 1 sản phẩm duy nhất
Ethene: CH2=CH2 + H2O → CH3CH2OH (duy nhất )
But-1-ene: CH3CH=CHCH3 + H2O → CH3CHOHCH2CH3 (duy nhất)
Đun sôi 7,85 gam isopropyl chloride trong NaOH/C2H5OH dư thu được một alkene. Cho alkene này qua dung dịch chứa 24 gam bromine, sau khi phản ứng xảy ra hoàn toàn thêm tiếp dung dịch KI đến dư thì thấy có 1,4 mol KI đã phản ứng. Hiệu suất của phản ứng tạo alkene ban đầu là:
nC3H7Cl bđ = 0,1 mol; nBr2 bđ = 0,15 mol
Gọi số isopropyl phản ứng là x:
C3H7Cl + NaOH C3H6 + NaCl + H2O
x → x
C3H6 + Br2 → C3H6Br2
x → x
Br2 + 2KI → 2KBr + I2
0,07 ← 0,14
nBr2 pư = 0,15 – 0,07 = 0,08 mol
x = nBr2 pư = 0,08 mol
Hiệu suất phản ứng:
Nhận định nào sau đây không đúng?
Một số dẫn xuất halogen chứa đồng thời chlorine, fluorine như CFCl2, CFCl3, C2F4Cl2,... được gọi chung là chlorofluorocarbon viết tắt là CFC. Không có nguyên tố Hydrogen.
Công thức tổng quát của anđehit no, mạch hở, 2 chức là
Công thức tổng quát của anđehit no, mạch hở, 2 chức là CnH2n-2O2 (n ≥ 2).
Khí ethylene dễ hóa lỏng hơn methane vì phân tử ethylene
Chất nào sau đây tác dụng với dung dịch Cu(OH)2 tạo thành phức màu xanh lam:
Phản ứng nào sau đây không tạo ra ethanal?
Phản ứng khôngh tạo ra ethanal:
CH3OH + CuO HCHO + Cu + H2O
Có ba ống nghiệm chứa các dung dịch trong suốt: ống 1 chứa ethyl alcohol; ống 2 chứa acetic acid và ống 3 chứa aldehyde acetic. Nếu cho Cu(OH)2 lần lượt vào các dung dịch trên và đun nóng thì
2CH3COOH + Cu(OH)2 → (CH3COO)2Cu + 2H2O
CH3CHO + 2Cu(OH)2 → CH3COOH + Cu2O↓ + 2H2O
Propanoic acid có công thức cấu tạo là
Propanoic acid là acid mà trong phân tử có 3 nguyên tử carbon.
Hai alcohol nào sau đây cùng bậc?
Methanol (CH3OH) và allyl alcohol (CH2=CH–CH2–OH) đều là alcohol bậc một.
Đun nóng hỗn hợp gồm hai alcohol đơn chức, mạch hở, kế tiếp nhau trong dãy đồng đẳng với H2SO4 đặc ở 140oC. Sau khi các phản ứng kết thúc, thu được 6 gam hỗn hợp gồm ba ether và 1,8 gam nước. Công thức phân tử của hai alcohol trên là
2 R-OH R-O-R + H2O
a 0,5a
nH2O = 0,5a = 1,8/18 = 0,1 a = 0,2
malcohol = mether + mH2O = 6 + 1,8 = 7,8 gam
Malcohol = R + 17 = 7,8/0,2 = 39
R = 22
Vậy hai alcohol là CH3-OH và C2H5-OH
X có CTPT C20H36Om. Biết X là một aldehyde no, mạch hở. Giá trị của m là
Ta có X là một aldehyde no, mạch hở nên X chỉ chứa liên kết π ở nhóm chức CHO:
Độ bất bão hòa trong X:
m = 3
Sản phẩm chính theo quy tắc Zaitsev của phản ứng tách HCl ra khỏi phân tử 2-chloro-3-methyl butane là:
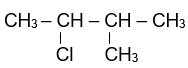
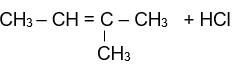
2-chloro-3-methyl butane 2-methylbut-2-ene
Đime hóa axetilen trong điều kiện thích hợp thu được chất nào sau đây?
Phản ứng đime hóa:
2CH≡CH CH2=CH–C≡CH
⇒ thu được vinylaxetilen
Hiện tượng xảy ra khi đun nóng toluen với dung dịch thuốc tím là:
Hiện tượng xảy ra khi đun nóng toluene với dung dịch thuốc tím là dung dịch KMnO 4 bị mất màu.
Đốt cháy hết a mol acid X được 2a mol CO2. Để trung hoà vừa hết a mol X cần 2a mol NaOH. Tìm X
nCO2/nX = 2 X chứa 2 C
X tác dụng với NaOH theo tỉ lệ 1 : 2 X chứa 2 nhóm –COOH
X là HOOC-COOH.
Cho sơ đồ phản ứng sau:
![]()
Công thức cấu tạo thu gọn của X là
Cấu tạo isobutyric acid là (CH3)2CCOOH → Z là aldehyde: (CH3)2CHCOH.
2(CH3)2CH-CHO + O2 2(CH3)2CH-COOH.
CuO, to ⇒ Y là isobutyl alcohol: (CH3)2CH-CH2OH:
(CH3)2CH-CH2OH + CuO (CH3)2CH-CHO + H2O.
Theo đó, cấu tạo của X thỏa mãn trong 4 đáp án là: CH2=C(CH3)-CHO:
CH2=C(CH3)-CHO + 2H2 → (CH3)2C-CH2OH.
Lượng chlorobenzene thu được khi cho 23,4 gam C6H6 tác dụng hết với Cl2 (xúc tác bột FeBr3) với hiệu suất phản ứng đạt 80% là:
Hiệu suất phản ứng đạt 80%
⇒ nC6H6 phản ứng =
Phương trình phản ứng hóa học xảy ra:
C6H6 + Cl2 C6H5Cl + HCl (1)
0,24 0,24 mol
Vậy khối lượng chlorobenzene thu được là: 0,24.112,5 = 27 gam.
Cho 3,3 gam một aldehyde X đơn chức, mạch hở phản ứng với lượng dư AgNO3 trong dung dịch NH3, đun nóng. Lượng Ag sinh ra cho phản ứng hết với acid HNO3 loãng, thoát ra 1,12 lít khí NO (sản phẩm khử duy nhất, (đktc)). Công thức cấu tạo thu gọn của X là
Xét phương trình phản ứng
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
Ta có: nAg = 3nNO = 0,15 mol
Vì X là Aldehyde đơn chức, mạch hở nên ta xét hai trường hợp sau:
Trường hợp 1: Aldehyde là HCHO
1 aldehyde → 4Ag
⇒ nX = .nAg = 0,15:4 = 0,0375 mol
⇒ MX = 3,3 : 0,0375 = 88 gam/mol (Không thỏa mãn)
Trường hợp 2: Aldehyde không phải là HCHO
1 Aldehyde → 2 Ag
→ nX = .0,15 = 0,075 mol
→ MX = 3,3:0,075 = 44 gam/mol.
Vậy công thức thỏa mãn (CH3CHO).
Aldehyde no, đơn chức, mạch hở có công thức phân tử chung là:
Aldehyde no, đơn chức, mạch hở có công thức phân tử chung là CnH2nO (n ≥ 1)
Tên gọi theo danh pháp thay thế của dẫn xuất halogen có công thức cấu tạo CH3CHClCH3 là
Tên gọi theo danh pháp thay thế của dẫn xuất halogen có công thức cấu tạo CH 3 CHClCH3 là 2-chloropropane.
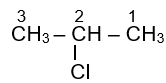
2-chloropropane
Phenol là hợp chất hữu cơ, trong phân tử có
Phenol là hợp chất hữu cơ, trong phân tử có nhóm -OH liên kết trực tiếp với nguyên tử carbon của vòng benzene.
Hỗn hợp M gồm alcohol no, đơn chức X và carboxylic đơn chức Y, đều mạch hở có cùng số nguyên tử C, tổng số mol hai chất là 0,5 mol (số mol Y lớn hơn số mol X). Nếu đốt cháy hoàn toàn M thì thu được 33,6 lít khí CO2 (đktc) và 25,2 gam H2O. Mặt khác, nếu đun nóng M với H2SO4 đặc để thực hiện phản ứng ester hóa (hiệu suất là 80%) thì số gam ester thu được là
nCO2 = 1,5 mol; nH2O = 1,4 mol
Số C trung bình = 1,5/0,3 = 3 nguyên tử
Số H trung bình = (1,4.2)/0,5 = 5,6 nguyên tử
Mà X là alcohol no, đơn chức ⇒ X là C3H8O.
Y là carboxylic đơn chức ⇒ Y là C3H4O2 hoặc C3H2O2
TH1: Acid là CH2=CH-COOH:
Gọi số mol CH2=CH-COOH và C3H7OH lần lượt là x và y mol:
CH2=CH-COOH + C3H7OH → CH2=CH-COOC3H7 + H2O
0,3 → 0,2 → 0,2
Do H = 80% ⇒ mester = 0,2.114.80% = 18,24 gam
TH2: Acid là CHC-COOH
Gọi số mol CHC-COOH và C3H7OH lần lượt là x và y mol:
Hỗn hợp khí A gồm alkene X và alkyne Y có cùng số nguyên tử carbon trong phân tử. Hỗn hợp A có khối lượng 18,6 gam và thể tích 11,1555 lít (ở đkc). Công thức phân tử tử X và Y.
nhỗn hợp = 11,1555 : 24,79 = 0,45 mol
Mtrung bình = 18,6 : 0,45 = 41
Gọi công thức alkene là CnH2n ⇒ Công thức alkyne là CnH2n-2
Vì Mtrung bình = 41 nên ta có: 14n > 41 và 14n- 2 < 41 ⇔ 41< 14n < 43 ⇒ n = 3
Gọi số mol của C3H6 và C3H4 lần lượt là a, b
Có ba ống nghiệm chứa các dung dịch trong suốt: ống 1 chứa ethyl alcohol; ống 2 chứa acetic acid và ống 3 chứa acetaldehyde. Nếu cho Cu(OH)2/OH− lần lượt vào các dung dịch trên và đun nóng thì:
- Alcohol đơn chức không tác dụng với Cu(OH)2.
- Carboxylic acid tác dụng với Cu(OH)2 ở nhiệt độ thường và đun nóng.
- Aldehyde tác dụng với Cu(OH)2 khi đun nóng.
Đốt cháy hoàn toàn a gam C2H5OH thu được 0,2 mol CO2. Đốt cháy hoàn toàn b gam CH3COOH thu được 0,2 mol CO2. Cho a gam C2H5OH tác dụng với b gam CH3COOH có xúc tác là H2SO4 đặc và đun nóng (giả sử hiệu suất phản ứng là 100%) thì thu được số gam ester là
nC2H5OH = .nCO2 = 0,1 mol; nCH3COOH =
.nCO2 = 0,1 mol
⇒ Hai chất phản ứng vừa đủ với nhau.
Phương trình phản ứng:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
mol: 0,1 → 0,1
⇒ mester = 0,1.88 = 8,8 (gam)
