Chất nào sau đây chỉ có tính khử?
Chất chỉ có tính khử khi chỉ có khả năng nhường eletcron.
⇒ Fe là chất chỉ có tính khử.
Chất nào sau đây chỉ có tính khử?
Chất chỉ có tính khử khi chỉ có khả năng nhường eletcron.
⇒ Fe là chất chỉ có tính khử.
Ion có số oxi hóa +2 trong hợp chất nào sau đây?
Fe+3(OH)3, Al+3Cl3-1, Fe+2SO4, Na+12O-2
Số oxi hóa của nguyên tử S trong hợp chất SO2 là
Gọi số oxi hóa của nguyên tử S trong hợp chất SO2 là x:
⇒ x + (–2).2 = 0 ⇒ x = +4.
Trong phản ứng oxi hóa - khử
a) Chất bị oxi hóa cho electron và chất bị khử nhận electron. Đúng||Sai
b) Trong phản ứng oxi hóa khử, sự oxi hóa và sự khử luôn xảy ra đồng thời.Đúng||Sai
c) Chất chứa nguyên tố số oxi hóa cực đại luôn là chất khử. Sai||Đúng
d) Quá trình nhường electron là quá trình khử và quá trình nhận electron là quá trình oxi hóa. Sai||Đúng
Trong phản ứng oxi hóa - khử
a) Chất bị oxi hóa cho electron và chất bị khử nhận electron. Đúng||Sai
b) Trong phản ứng oxi hóa khử, sự oxi hóa và sự khử luôn xảy ra đồng thời.Đúng||Sai
c) Chất chứa nguyên tố số oxi hóa cực đại luôn là chất khử. Sai||Đúng
d) Quá trình nhường electron là quá trình khử và quá trình nhận electron là quá trình oxi hóa. Sai||Đúng
a) Đúng
b) Đúng
Trong phản ứng oxi hóa – khử quá trình oxi hóa và quá trình khử xảy ra đồng thời.
c) Sai vì
chất chứa nguyên tố có số oxi hóa cực đại có thể là chất oxi hóa hoặc chất khử:
HNO3 chứa N+5 (N có số oxi hóa cực đại) là chất oxi hóa trong phản ứng:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
HCl chứa H+1 (số oxi hóa cực đại) là chất khử trong phản ứng:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
d) Sai vì
Quá trường nhường electron là quá trình oxi háo, quá trình nhận electron là quá trình khử.
Khí oxygen thể hiện tính chất gì khi tham gia các phản ứng đốt cháy nhiên liệu?
Các phản ứng đốt cháy nhiên liệu oxygen dạng O2 tạo thành H2O và CO2.
Số oxi hóa giảm từ 0 xuống -2 ⇒ Oxygen đóng vai trò là chất oxi hóa.
Trong hợp chất SO3, số oxi hoá của sulfur (lưu huỳnh) là
Gọi số oxi hóa của S trong SO3 là x, ta có:
x + (–2).3 = 0 ⇒ x = +6
Iron có số oxi hóa +2 trong hợp chất nào sau đây?
Trong hợp chất FeSO4 iron có số oxi hóa +2.
Trong các hợp chất Fe2O3, FeCl3, Fe(OH)3, iron có số oxi hóa +3.
Phản ứng oxi hóa - khử là
Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có sự dịch chuyển electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một nguyên tử trong phân tử.
Vai trò của NO2 trong phản ứng NO2 + NaOH → NaNO2 + NaNO3 + H2O là
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố trong phản ứng là:
Nguyên tử N trong NO2 vừa nhường electron, vừa nhận electron NO2 vừa là chất khử, vừa là chất oxi hóa.
Phương trình phản ứng oxi hoá - khử là phương trình nào dưới đây?
Phương trình Fe + 3AgNO3 → Fe(NO3)3 + 3Ag vì có sự thay đổi số oxi hóa Fe lên Fe+3 và Ag+ xuống Ag
Cho các phân tử có công thức cấu tạo sau:
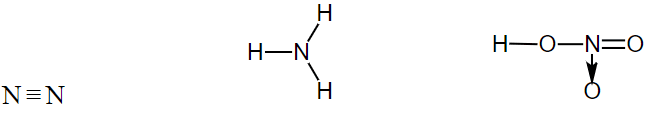
Số oxi hoá của nguyên tử N trong các phân tử trên lần lượt là
Dựa vào quy tắc xác định số oxi hóa ta có:
Phương trình phản ứng nào sau đây không thể hiện tính khử của ammonia (NH3)?
Ta thấy phản ứng: NH3 + HCI → NH4CI không có sự thay đổi số oxi hóa ⇒ phản ứng không phải phản ứng oxi hóa khử hay không thể hiện tính khử của ammonia.
Cho vào ống nghiệm 2 – 3 ml dung dịch H2SO4 1 M, sau đó thả vài mẩu kẽm hạt vào. Kẽm phản ứng với H2SO4 theo phương trình hoá học:
Zn + H2SO4 → ZnSO4 + H2
Nhận xét nào sau đây là sai?
Trong phản ứng hóa học, xảy ra các quá trình:
Zn nhường electron nên là chất khử ⇒ đúng.
Quá trình H+ nhận electron là quá trình khử ⇒ đúng.
Quá trình H+ nhận electron là quá trình oxi hoá ⇒ sai.
Ion H+ đã nhận electron nên H+ là chất oxi hoá ⇒ đúng.
Số oxi hóa của nguyên tố N trong dãy các hợp chất nào dưới đây bằng nhau?
Trong NaNO3, HNO3, Fe(NO3)3; N2O5: số oxi hóa của N là +5
Trong NH3, NaNH2: số oxi hóa của N là -3; trong NO2 là +4; trong NO là +2.
Trong CH3NH2, số oxi hóa của N là -3, trong HNO2 là +3.
Trong KNO2, C6H5NO2 số oxi hóa của N là +3, trong NH4NO3 là -3 và +5.
Cho 1,8 gam kim loại Mg tác dụng với dung dịch acid nitric đặc, nóng, dư thu được V lít khí NO (ở 25oC, 1 bar, là chất khí duy nhất) và muối Mg(NO3)2. Giá trị của V là
Sự thay đổi số oxi hóa của các nguyên tử:
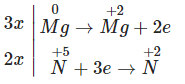
Phương trình cân bằng là:
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
Theo bài ra ta có:
Theo phương trình hóa học:
⇒ VNO = 0,05.24,79 = 1,2395 lít
Cảnh sát giao thông sử dụng các dụng cụ phân tích rượu etylic có chứa CrO3. Khi tài xế hà hơi thở vào dụng cụ phân tích trên, nếu trong hơi thở có chứa hơi rượu thì hơi rượu sẽ tác dụng với CrO3 có màu da cam và biến thành Cr2O3 có màu xanh đen theo phản ứng hóa học sau:
CrO3 + C2H5OH → CO2↑ + Cr2O3 + H2O
Tỉ lệ chất khử : chất oxi hoá ở phương trình hóa học trên là
Sự thay đổi số oxi hóa của các nguyên tử nguyên tố trong phản ứng:
Các quá trình xảy ra:
⇒ Chất khử là C2H5OH, chất oxi hóa là CrO3
Cân bằng phương trình phản ứng: 4CrO3 + C2H5OH → 2CO2↑ + 2Cr2O3 + 3H2O
⇒ Tỉ lệ chất khử : chất oxi hoá là 1 : 4.
Cho sơ đồ phản ứng:
KMnO4 + H2O2 + H2SO4 → MnSO4 + O2 + K2SO4 + H2O
Hệ số (nguyên, tối giản) của chất oxi hóa, chất khử là
Số oxi hóa của các nguyên tố thay đổi:
Các quá trình nhường nhận electron:
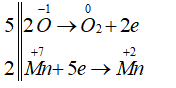
Vậy hệ số của KMnO4 là 2, hệ số của H2O2 là 5.
Cho phản ứng: aAl + bHNO3 → cAl(NO3)3 + dN2O + eH2O. Các hệ số a, b, c, d, e là những số nguyên tối giản. Tổng (d + e) bằng bao nhiêu?
Phương trình phản ứng
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O + 15H2O
d: N2O
e: H2O
Tổng (d +e) = 3 + 15 = 18
Cho sơ đồ của phản ứng oxi hóa - khử sau: Mg + HNO3 → Mg(NO3)2 + NO + H2O.
Hòa tan hoàn toàn 7,2 gam magnesium vào dung dịch nitric acid loãng. Tính thể tích khí nitrogen monooxide (NO) tạo thành ở điều kiện chuẩn.
- Lập phương trình phản ứng:
Sự thay đổi số oxi hóa của các nguyên tử:
Thăng bằng electron:
Cân bằng phản ứng: 3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
- Tính thể tích khí NO:
nMg = 0,3 (mol)
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
mol: 0,3 → 0,2
⇒ VNO = 0,2.24,79 = 4,958 (lít)
Hòa tan hoàn toàn một lượng 31,32 gam một oxit Fe bằng dung dịch H2SO4 đặc, nóng thu được dung dịch A và 4,872 lít khí SO2 (sản phầm khử duy nhất, ở đktc). Cô cạn dung dịch A, thu được m gam muối Fe2(SO4)3 khan. Xác định giá trị m là:
Quy đổi hỗn hợp oxide Fe thành Fe và O
Gọi x, y lần lượt là số mol của của Fe và O
nSO2 = 4,872 : 22,4 = 0,2175 mol
Quá trình nhường e Fe0 → Fe+3 + 3e x → 3x | Quá trình nhận e O0 + 2e → O-2 x → 2y S+6 + 2e → S+4 0,435 ← 0,2175 |
Áp dụng định luật bảo toàn electron, ta có:
3x = 2y + 0,29 → 3x - 2y = 0,435 (1)
Ta có theo đề bài: 56x + 16y = 31,32 (2)
Từ (1) và (2) → x = 0,435 và y = 0,435
Áp dụng định luật bảo toàn nguyên tố ta có:
nFe2(SO4)3 = 1/2nFe = 0,2175 mol
→ mFe2(SO4)3 = 0,2175. 400 = 87 (g)
